Il y a un peu plus d'un siècle, un scientifique français peu connu du nom d'Henri Becquerel a découvert quelque chose de nouveau et d'immensément surprenant. Avec le temps, ces rayons se sont révélés être présents dans plusieurs éléments naturels et ont été surnommés radioactivité. Les métaux qui les présentaient sont également connus sous le nom d'isotopes radioactifs.
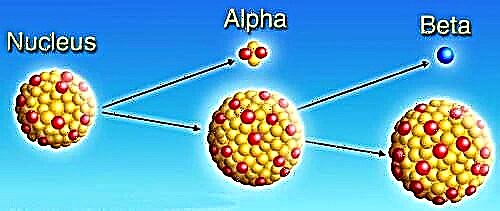
Les radio-isotopes (également appelés isotopes radioactifs ou radionucléides) sont des atomes avec un nombre de neutrons différent de celui d'un atome habituel. En raison de ce déséquilibre, ces isotopes ont un noyau instable qui se désintègre et émet dans le processus des rayons alpha, bêta et gamma jusqu'à ce que l'isotope atteigne la stabilité. Une fois stable, l'isotope s'est entièrement transformé en un autre élément. Chaque élément chimique possède un ou plusieurs radio-isotopes, avec plus de 1 000 isotopes au total. Environ 50 d'entre eux se trouvent dans la nature; les autres sont produits artificiellement comme le résultat direct de réactions nucléaires ou indirectement comme les descendants radioactifs de ces produits.
Parmi les radio-isotopes naturels, trois catégories sont utilisées pour les regrouper. Le premier est les radionucléides primordiaux, qui proviennent principalement de l'intérieur des étoiles et comme l'uranium et le thorium, sont toujours présents parce que leurs demi-vies sont si longues qu'elles ne se sont pas encore complètement décomposées. Le deuxième groupe, les radionucléides secondaires, sont des isotopes radiogéniques dérivés de la désintégration des radionucléides primordiaux et se caractérisent par leur demi-vie plus courte. Le troisième et dernier groupe est celui des radionucléides cosmogéniques connus, qui se composent d'isotopes comme le carbone 14 qui sont constamment produits dans l'atmosphère en raison des rayons cosmiques. Les radionucléides produits artificiellement, d'autre part, sont produits par des réacteurs nucléaires, des accélérateurs de particules ou par des générateurs de radionucléides (où un isotope parent, généralement produit dans un réacteur nucléaire, peut se désintégrer pour produire un radio-isotope). De plus, les explosions nucléaires sont également connues pour produire des radio-isotopes artificiels.
Les radio-isotopes sont utilisés aujourd'hui à diverses fins. Dans le domaine de la médecine nucléaire, les isotopes radioactifs sont utilisés en IRM et aux rayons X à des fins diagnostiques, pour une radiothérapie ciblée et pour stériliser du matériel médical. En biochimie et génétique, les radionucléides sont utilisés dans la recherche moléculaire et ADN afin de «marquer» les molécules et de suivre les processus chimiques et physiologiques. Le carbone 14, un isotope cosmogène naturel, est utilisé pour la datation au carbone par les archéologues, les paléontologues et les géologues. En agriculture, le rayonnement est utilisé pour arrêter la germination des racines, tuer les parasites et les ravageurs, et en médecine vétérinaire. Et en ce qui concerne l'industrie, les radionucléides sont utilisés pour étudier le taux d'usure et de corrosion des métaux, pour tester les fuites et les joints, analyser les polluants, étudier le mouvement des eaux de surface, mesurer les écoulements d'eau de la pluie et de la neige, et les débits des ruisseaux et des rivières.
Nous avons écrit de nombreux articles sur les radio-isotopes pour Space Magazine. Voici un article sur les isotopes, et voici un article sur la désintégration radioactive.
Si vous souhaitez plus d'informations sur les radio-isotopes, consultez ces articles du NDT Resource Center et Science Courseware.
Nous avons également enregistré un épisode entier d'Astronomy Cast consacré à l'ère de l'univers. Écoutez ici, épisode 122: Quel âge a l'Univers?.
Références:
http://en.wikipedia.org/wiki/Radionuclide
http://en.wikipedia.org/wiki/Radioactive_decay
http://www.britannica.com/EBchecked/topic/489027/radioactive-isotope
http://en.wikipedia.org/wiki/Radiocarbon_dating
http://www.ehow.com/about_5095610_radioactive-isotopes.html